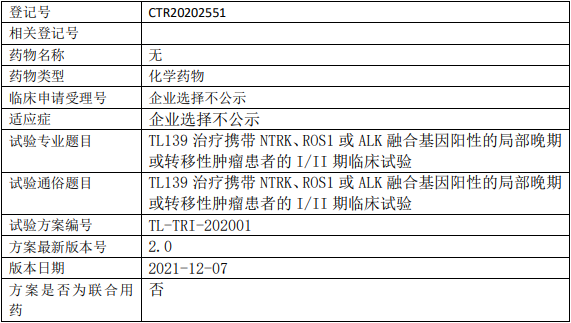
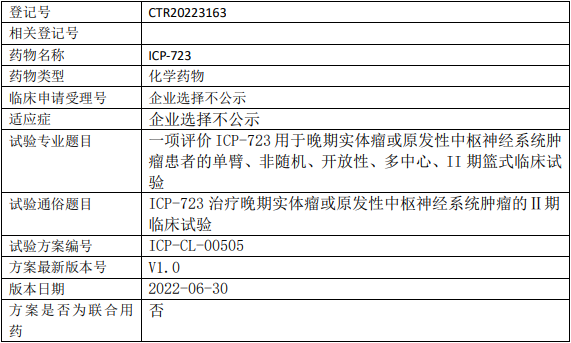
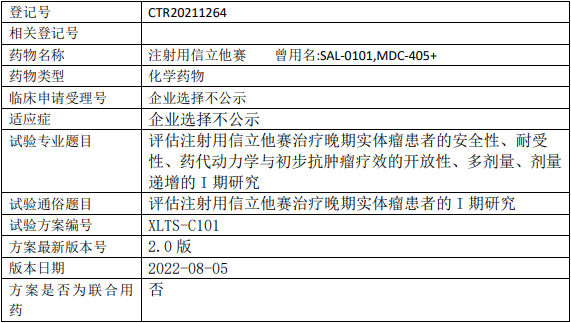
启德医药GQ1001临床试验,靶向HER2靶点的抗体偶联药物GQ1001静脉输注液治疗HER2阳性晚期实体肿瘤的I期临床试验
启德医药GQ1001临床试验,靶向HER2靶点的抗体偶联药物GQ1001静脉输注液治疗HER2阳性晚期实体肿瘤的I期临床试验

试验目的
1、评估GQ1001的剂量限制性毒性(DLT)以确定最大耐受剂量(MTD)或扩展推荐剂量(DRDE)。
2、评估GQ1001注射液在HER2阳性晚期实体肿瘤受试者中的安全性和耐受性。
3、考察不同剂量下,GQ1001注射液在HER2阳性晚期实体瘤受试者中的药代动力学(PK)特征。
4、观察GQ1001注射液在HER2阳性晚期实体瘤受试者中的抗肿瘤活性
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限 (最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、已签署知情同意书并能够遵循临床试验方案;
2、年龄大于18周岁的男性或女性;
3、ECOG 体能状态评分 0 或 1,预期生存时间 ≥ 3 个月;
4、超声心动图(ECHO)测定左室射血分数(LVEF)≥50%;
5、受试者需有病理报告证实为HER2 阳性的晚期/不可切除或转移性实体肿瘤(定义如下),经标准治疗复发或难治或现阶段疾病进展且无标准治疗。受试者必须至少有一个可测量的疾病病灶。用于测定HER2 状态的肿瘤标本应在过去6 个月内获取。
6、在筛选期和第一次治疗前7天,有适当的器官功能;
7、在第一次治疗前证实有适当的洗脱期;
8、根据研究者判断,受试者没有获得性免疫缺陷综合症(AIDS)定义机会性感染史,或受试者有AIDS定义机会性感染史但在过去12个月内没有出现机会性感染,仍可入组。
排除标准
1、临床症状的脑转移,定义为未经治疗且有症状,或需要类固醇或抗惊厥药物治疗以控制相关症状。经治疗后的脑转移已不再有症状,且无需类固醇治疗的受试者,如果已从化疗或放疗的急性毒性作用中恢复,可被纳入研究;
2、2年内患有多种原发性恶性肿瘤的受试者,充分切除的非黑色素瘤皮肤癌、已治愈的原位肿瘤、已治愈的其他实体瘤或对侧乳腺癌除外;
3、心血管功能障碍或有临床意义的心脏病;
4、有临床意义的肺部疾病(如间质性肺炎、肺炎、肺纤维化和严重放射性肺炎)病史,或在筛选期影像学检查时或需要补充氧时怀疑有这些疾病的试者;
5、已知对研究产品中的药物物质或非活性成分过敏者;
6、患有≥2 级外周神经障碍;
7、先前抗肿瘤治疗未恢复的毒性,定义为尚未恢复到NCI-CTCAE 5.0版,≤1 级或基线的毒性(脱发除外);如受试者存在慢性2 级毒性,研究者可酌情判断是否合格;
8、蒽环类药物的累积剂量>360 mg/m2 或同等剂量阿霉素;
9、不可控制的感染,需要进行静脉输注抗生素,抗病毒药或抗真菌药;
10、活动性丙型肝炎(例如,可检测到抗丙型肝炎病毒[HCV]抗体)或乙型肝炎病毒感染(例如,乙型肝炎表面抗原[HBsAg]阳性),但如果在筛选时检测不到乙型肝炎病毒(HBV)脱氧核糖核酸(DNA),则可纳入隐匿性或既往乙型肝炎感染的受试者(定义为总乙型肝炎核心抗体阳性和HBsAg阴性),这些受试者必须愿意每月接受一次DNA 检测和适当的抗病毒治疗(如出现指征);
11、根据研究者判断,有任何伴随疾病治疗或实验室异常的病史或当前证据的受试者,可能会干扰试验结果,干扰受试者的参与和依从性;
12、哺乳期妇女或首次治疗前7 天内进行妊娠试验证实怀孕的妇女;
13、在研究期间以及最后一次使用GQ1001后至少7个月内不愿意使用适当避孕方法(例如,同时使用杀精剂,屏障避孕药和/或宫内避孕 药)的男性和女性受试者。