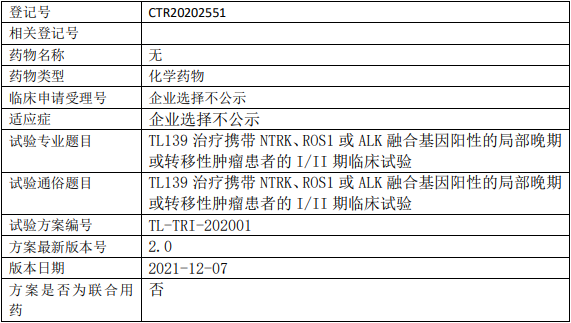
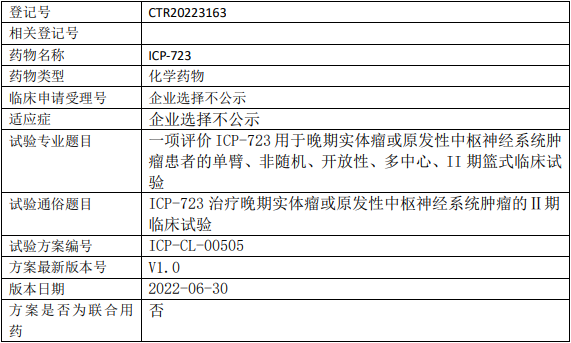
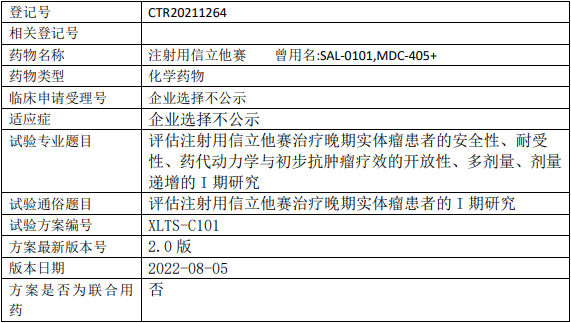
葆元生物AB106临床试验,AB-106胶囊治疗携带NTRK融合基因实体瘤受试者安全性和有效性的II期临床试验
葆元生物AB106临床试验,AB-106胶囊治疗携带NTRK融合基因实体瘤受试者安全性和有效性的II期临床试验

试验目的
主要目的
评估AB-106治疗携带NTRK融合基因的晚期肿瘤成人受试者的有效性。
次要目的
以其它相关终点评价AB-106单药治疗携带NTRK 融合基因的实体瘤受试者的有效性。
评估AB-106治疗的安全性和耐受性。评估AB-106药代动力学(PK)。
探索目的
探索可以预测AB-106 疗效的相关基因;
探索AB-106单药治疗后疾病进展(PD)时可能的耐药机制。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、诊断为携带NTRK1、NTRK2、NTRK3 融合基因(预计分别转化成具有一个功能性TrkA/B/C 激酶结构域的融合蛋白的NTRK1/2/3)的局部进展或全身转移的实体肿瘤;
2、标准治疗失败或拒绝接受标准治疗的受试者;
3、按RECIST 1.1 定义的,受试者必须至少有一处病灶可测量;
4、对于诊断CNS 原发肿瘤的受试者应满足下述标准:
(1)曾接受过既往治疗,包括放疗(第1 治疗周期第1 天前明确进展)、化疗、靶向治疗(第1 治疗周期第1 天的4 周前完成)。
(2)有≥1 个病灶可进行二维测量(经MRI 确认,按照RANO 标准可评估),至少一处可测量病灶的每个维度尺寸≥1cm,且不只在一个影像片上观察到。
5、年满18 岁以上的男性或女性;
6、ECOG 评分≤2 分;
7、研究者判断受试者的生存期可超过3 个月;
8、按下述标准定义的器官功能完好:
(1)中性粒细胞绝对计数≥1.5×10^9/L,血小板≥80×10^9/L,血红蛋白≥90 g/L。
(2)血清天门冬氨酸氨基转移酶(AST)和血清丙氨酸氨基转移酶(ALT)≤2.5×正常范围上限(ULN),有肝脏肿瘤者AST 与ALT≤5×ULN。
(3)总胆红素≤1.5×ULN。已知有吉尔伯特病史且间接胆红素异常升高的受试者是合格的。
(4)血清肌酐≤2.0×ULN;尿试纸检测尿蛋白
9、凝血功能:国际标准化比率(INR)≤1.5,且部分凝血酶原时间(PT)或活化部分凝血酶原时间(APTT)≤1.5×ULN。
10、受试者需能够提供已经存档的或新近取得的肿瘤组织标本(包括同意新采集活检标本);
11、既往治疗可包括不超过3 线的化疗、放疗[姑息治疗除外]或手术;
12、入组前,受试者(或法定代表)已充分知情,且在知情同意书上签名、签署日期;
13、在治疗期间及完成研究治疗后至少90天内,同意使用有效避孕措施(不包括绝育手术后的男性,或绝育手术后及绝经后的女性)。其中,有生育能力的女性,需在首次给药前7天内的检测血人绒毛膜促性腺激素(HCG)并呈阴性。
排除标准
1、首次服用AB-106 前4 周内正在另一项治疗性临床试验中接受治疗;
2、曾接受过针对NTRK 融合基因的靶向治疗
3、既往治疗引起的未消退的≥2 级毒性反应,不具有安全性风险的AE 除外(如脱发、神经疾病、特定的实验室检查异常);
4、有症状或不稳定的脑转移受试者(无症状的脑转移受试者可以入选),CNS 原发肿瘤也可以入选,但需病情稳定至少7天;
5、在开始研究前28天内进行过外科大手术或放疗,或预期在研究过程中需要进行外科大手术的受试者;
6、已知患间质性肺病、间质纤维化、或酪氨酸激酶抑制剂诱发的肺炎;
7、患有活动性、不可控的全身性细菌性、病毒性或真菌性感染、难于依从研究流程的其他全身性疾病
8、乙肝或丙肝活动期(HBsAg阳性和/或HBcAb阳性且HBV DNA≥10^4 拷贝数或者≥2000IU/ml;HCV抗体阳性,且HCV-RNA阳性或HCV-RNA>正常值范围上限)
9、有免疫缺陷病史,包括HIV 检测阳性或患有其他获得性、先天性免疫缺陷疾病,或有器官移植史。
10、开始使用研究药物前28 天内和/或研究期间预计将系统全身使用的药物是CYP3A4 的强效抑制剂,包括(但不限于)阿扎那韦、克拉霉素、茚地那韦、伊曲康唑、酮康唑、奈法唑酮、奈非那韦、利托那韦、沙奎那韦、泰利霉素、醋竹桃霉素、伏立康唑、葡萄柚或葡萄柚汁;
11、开始使用研究药物前28 天内和/或研究期间预计将系统全身使用的药物是CYP3A4 强效诱导剂,其中包括(但不限于)卡马西平、苯巴比妥、苯妥英、利福布汀、利福平和圣约翰草;
12、开始使用研究药物前28 天和预期研究期间使用的药物是治疗指数很小的CYP3A4 底物,这些药物包括(但不限于这些)二氢麦角胺、麦角胺、匹莫齐特、阿司咪唑、西沙必利和特非那定
13、开始使用研究药物前14 天内和/或研究期间预计将使用其他任何抗肿瘤药物,包括说明书中有明确抗肿瘤适应症的中药、中成药、中草药(含汤剂)等;
14、既往有明确的神经或精神障碍史,如癫痫或痴呆等依从性差者;
15、有吸毒或药物滥用史者;
16、因肿瘤导致的脊髓受压(除非受试者的疼痛完全被控制住,且神经功能稳定或得到恢复)、癌性脑膜炎或软脑膜疾病;经研究者判断具有脑疝风险;
17、患有活动性消化性溃疡、明显呕吐、慢性腹泻、肠梗阻、吸收障碍等或其他已知会影响药物吸收的疾病;存在吞咽困难或严重影响药物吸收的其他情况,例如已接受过胃或肠切除术;
18、在入组前3 个月内,曾患不稳定的心血管疾病或发生以下情况:
1)心肌梗死、严重/不稳定心绞痛、冠状动脉/外周动脉搭桥术、充血性心力衰竭(NCI CTCAEv5.0≥3 级)等;
2)入组时患有心律失常(NCI CTCAEv5.0≥2 级)、不可控心房纤颤(任意分级)或女性QTc>470 毫秒或男性QTc>450 毫秒;
19、在入组前3 个月内,曾发生脑血管意外(除外短暂性脑缺血发作);
20、有其他恶性肿瘤病史。不包括已根治的非黑色素瘤皮肤癌、原位宫颈癌、前列腺上皮内瘤。如果入组前5 年及以上诊断为其他恶性肿瘤,必须同时满足以下条件方可入组:①目前不存在活跃病灶;②研究者判断复发风险低;③不会干扰AB-106 疗效评估。
21、经研究者和申办者判断,存在其他严重急性或慢性躯体疾病、精神疾病或实验室异常,以及可能产生与参加研究或给予研究药物相关的过度风险的疾病或异常。