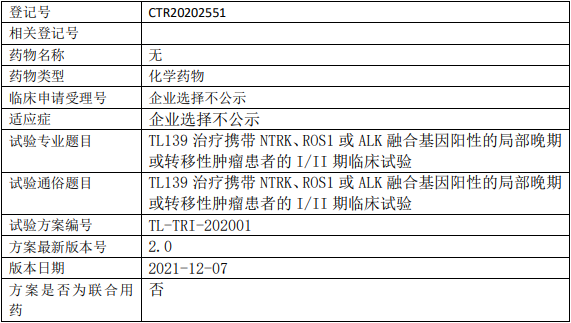
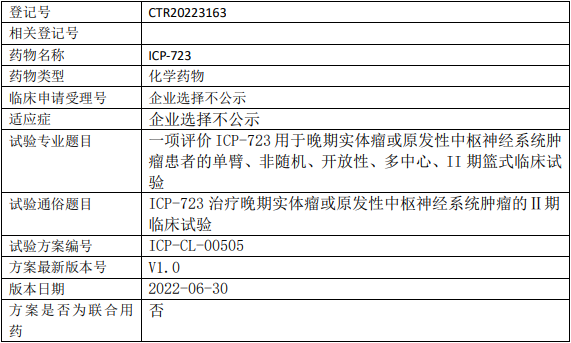
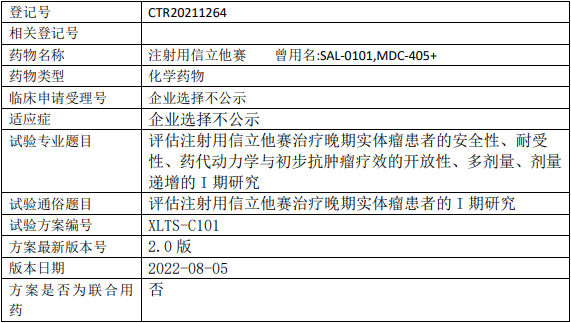
德润玉成普维替尼临床试验,普维替尼胶囊治疗HER2表达阳性晚期实体瘤患的Ia期临床试验
德润玉成普维替尼临床试验,普维替尼胶囊治疗HER2表达阳性晚期实体瘤患的Ia期临床试验

试验目的
评价HER2表达阳性晚期实体瘤患者单次及后续多次口服普维替尼胶囊的安全性、耐受性和药代动力学特征,为后期临床试验的方案设计提供依据
试验设计
试验分类:药代动力学/药效动力学试验
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至 70岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18-70周岁,男女不限
2、经病理组织学或细胞学确诊的晚期实体瘤患者
3、组织学或细胞学检查证实的HER2表达阳性晚期实体瘤患者(HER2表达阳性指不少于10%的肿瘤细胞免疫组化染色强度为2+且经荧光原位杂交技术[FISH]确认阳性者,或免疫组化染色强度为3+[染色强度范围0~3])
4、经过常规抗肿瘤治疗后失败、或现阶段不适用常规治疗方案
5、距最近一次化疗时间至少4周(口服氟尿嘧 啶类药物距末次服药至少14天),丝裂霉素C 以及 亚硝基脲需要距末次用药至少6 周;如果接受过抗肿瘤生物制品,则至少需经过4 周的洗脱期;
6、以往治疗引起的毒副反应,则需要恢复至≤1级(NCI-CTCAE5.0),脱发除外
7、体力状况评分(Performance Status,PS)评分,ECOG 0–1级
8、预计生存时间3个月以上
9、器官的功能水平必须符合下列要求:
●ANC≥1.5×109/L;
●PLT≥90×109/L;
●Hb≥90 g/L;
●TBIL≤1.5×ULN;
●ALT和AST≤2.5×ULN;
●ALT和AST≤5×ULN(对于有肝转移灶者);
●BUN和Cr≤1.5×ULN或肌酐清除率≥50mL/min(Cockcroft-Gault公式);
●LVEF≥50%;
●Fridericia法校正的QT间期(QTcF)男性。
10、有生育能力的合格受试者(男性和女性)必须同意在试验期间和末次给药后至少12周内使用可靠的避孕方法(激素或屏障法或禁欲)。育龄期的女性受试者在入选前7天内的血妊娠试验必须为阴性
11、受试者须在试验前对本研究知情同意,并自愿签署书面的知情同意书
排除标准
1、存在无法通过引流或其他方法控制的第三间隙积液(如大量胸水和腹水)
2、使用类固醇治疗超过50天,或需要长期使用类固醇
3、无法吞咽、慢性腹泻和肠梗阻,存在影响药物服用和吸收的多种因素
4、入组前4周内接受过放疗、激素治疗、手术; 或入组前7天内(或对应药物的5个半衰期内,以长者为准)接受过小分子靶向治疗者
5、入组时仍存在无法纠正的低钾血症和低镁血症
6、研究期间不能中断使用可能导致QT延长的药物(如抗心律失常药)
7、同时接受其他任何抗肿瘤治疗
8、4周内参加过其它药物临床试验
9、过敏体质者,或已知对本药组分有过敏史者
10、活动性感染(由研究者决定)
11、有免疫缺陷病史,包括HIV检测阳性,或患有其他获得性、先天性免疫缺陷疾病,或有器官移植史
12、患有曾任何心脏疾病,包括:
(1)心绞痛;
(2)需药物治疗的或有临床意义的心律失常;
(3)心肌梗死;
(4)心力衰竭;
(5)任何被研究者判断为不适于参加本试验的其他心脏疾病等
13、妊娠期、哺乳期女性患者或有生育能力女性的基线妊娠试验检测阳性
14、根据研究者的判断,有严重的危害患者安全、或影响患者完成研究的伴随疾病(如高血压、严重的糖尿病、甲状腺疾病等)
15、既往有明确的神经或精神障碍史,包括癫痫或痴呆
16、研究者认为受试者不适合参加本临床研究的