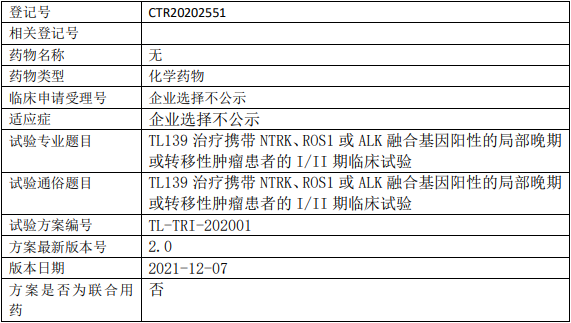
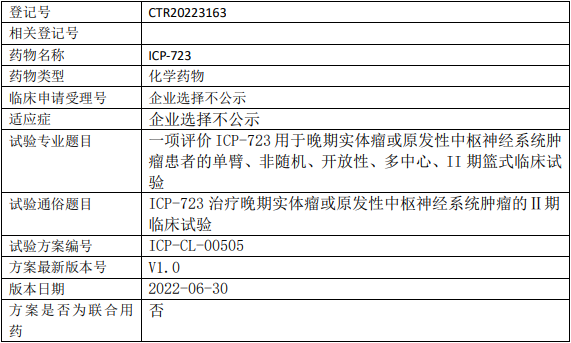
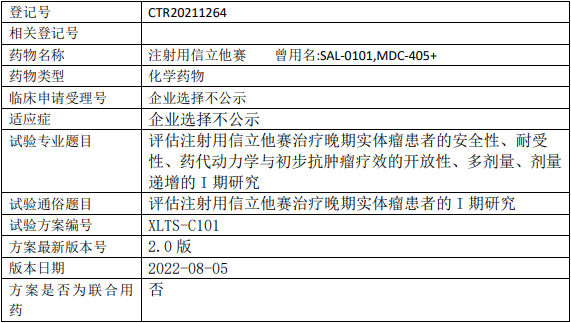
丹生医药SSGJ-707临床试验,评估SSGJ-707注射液治疗晚期或转移性实体瘤的安全性、耐受性、药代动力学和抗肿瘤活性的Ⅰ期临床试验
丹生医药SSGJ-707临床试验,评估SSGJ-707注射液治疗晚期或转移性实体瘤的安全性、耐受性、药代动力学和抗肿瘤活性的Ⅰ期临床试验

试验目的
Part 1:评估SSGJ-707在标准治疗无效/复发/无标准治疗/受试者拒绝标准治疗的晚期或转移性实体肿瘤受试者中的安全性和耐受性,并确定其RP2D;
Part 2:初步评估SSGJ-707在特定的晚期或转移性实体瘤受试者中的抗肿瘤疗效;
试验设计
试验分类:安全性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿参加本研究,签署知情同意书,依从性良好且愿意遵循配合完成所有试验程序
2、签署ICF时年龄≥18周岁且≤75周岁,男女不限
3、经至少一种标准系统治疗后失败、不耐受/拒绝标准治疗或缺乏标准治疗方法
4、经病理组织学或细胞学确诊的晚期或转移性实体瘤
5、根据RECIST v1.1标准评估具有至少一个可测量肿瘤病灶
6、ECOG体力状况评分(PS)0-1分
7、预期生存时间≥12周
8、根据在研究治疗开始前7天内的实验室检查结果,具有充分的血液学和器官功能
9、妊娠试验阴性的育龄期女性受试者或伴侣为育龄期妇女的男性受试者,需在整个研究治疗期及末次给药后至少6个月内采取有效的避孕措施
排除标准
1、已知对试验药物的任何成分有严重过敏史
2、首次给药前1周内接受过具有抗肿瘤适应症的中药
3、首次给药前2周内或研究期间需要长期接受全身糖皮质激素
4、既往有自身免疫性疾病病史且可能复发
5、签署ICF时或首次给药前6个月内存在严重心脑血管疾病
6、签署ICF时存在不能稳定控制的糖尿病、高血压等系统性疾病;
7、首次给药前4周内发生严重感染
8、首次给药前4周内经历过大手术,或研究期间计划进行大手术
9、筛选期影像学显示肿瘤侵犯大血管
10、首次给药前4周内存在严重出血情况
11、有遗传性出血倾向或凝血功能障碍
12、梅毒螺旋体或人体免疫缺陷病毒(HIV)检测呈阳性;
13、乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)阳性受试者
14、首次给药前72小时内,新型冠状病毒核酸检测结果呈阳性
15、首次给药前4周内参加过其他临床试验
16、研究者认为可能增加研究相关风险或干扰对研究结果的解释的其他情况