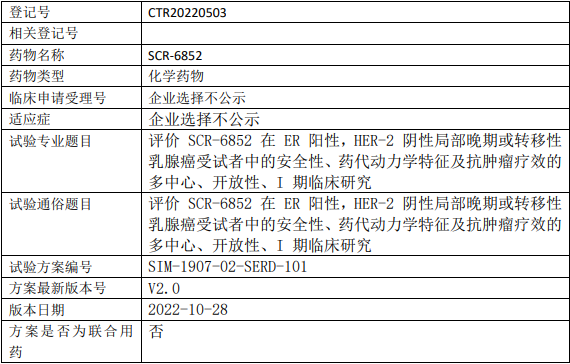
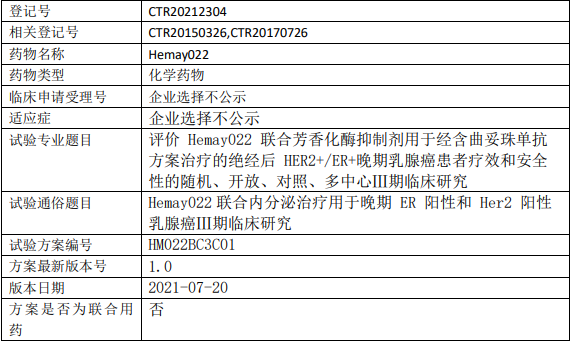
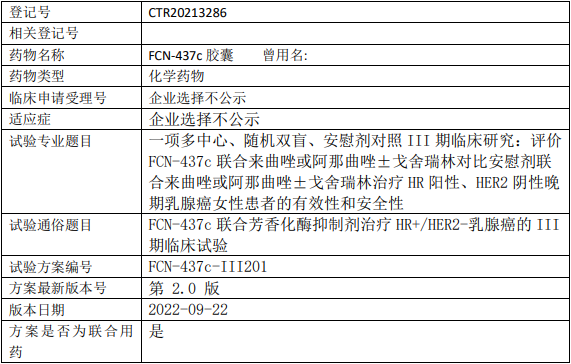
康方生物AK117临床试验,AK117/AK112联合化疗一线治疗不可切除的局部晚期或转移性三阴性乳腺癌的II期临床试验
康方生物AK117临床试验,AK117/AK112联合化疗一线治疗不可切除的局部晚期或转移性三阴性乳腺癌的II期临床试验
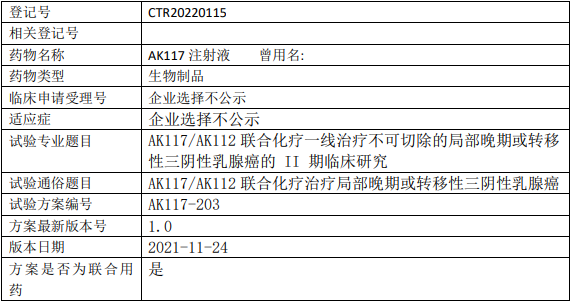
试验目的
评价AK117/AK112 联合化疗一线治疗局部晚期或转移性三阴性乳腺癌的有效性、安全性、耐受性、药代动力学(PK)以及免疫原性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿签署书面 ICF。
2、入组时年龄 ≥18 周岁,≤75 周岁。
3、东部肿瘤协作组织(ECOG)体能状况评分为0或1。
4、预期生存期≥3个月。
5、经组织学检查证实的局部晚期或转移性的TNBC(人表皮生长因子2 [HER2]、雌激素受体[ER]和孕激素受体[PR]阴性)的受试者。
6、受试者既往未接受过系统性抗肿瘤治疗,为不适合接受根治性手术切除或局部治疗的局部晚期或转移性TNBC患者,或经过手术切除或局部治疗后疾病进展的局部晚期或转移性的TNBC患者。
7、根据 RECIST v1.1 至少有一个可测量病灶。
8、受试者需提供最近日期存档的或新鲜获取的肿瘤组织样本。
9、要求确定良好的器官功能。
10、具有生育能力的女性受试者必须在首次用药前3天内进行尿液或血清妊娠检查,且结果为阴性。受试者研究期间及末次给药后120天内能够有效避孕。
11、受试者愿意而且能够遵守日程表规定的访视、治疗方案、实验室检查,及遵守研究的其他要求。
排除标准
1、局部复发适合接受手术或放疗的患者。
2、除参加研究的肿瘤类型外,受试者在入组前5年内患有其他恶性肿瘤。
3、存在活动性中枢神经系统(CNS)转移病灶。
4、存在有临床症状或需要反复引流的胸腔积液、心包积液或腹水的受试者。
5、患有在过去两年内需要系统性治疗的活动性自身免疫性疾病。
6、活动性乙型肝炎受试者或丙型肝炎受试者。
7、在首次用药前30天内进行过重大外科手术或发生严重外伤。
8、患有严重的心脑血管疾病。
9、首次用药前6个月内发生过血栓栓塞事件。
10、有严重出血倾向或凝血功能障碍病史。
11、在首次用药前的30天内接种了活疫苗,或计划在研究期间接种活疫苗。
12、已知对任何研究药物的任何成分过敏。
13、已知有精神疾病、药物滥用、酗酒或吸毒史。
14、妊娠期或哺乳期女性。