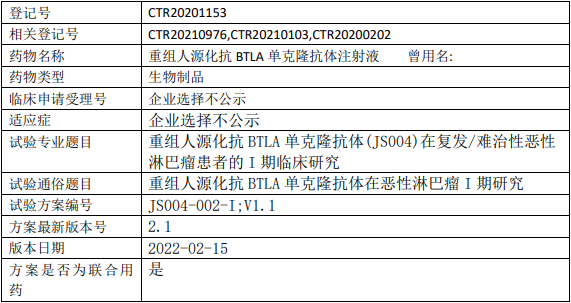
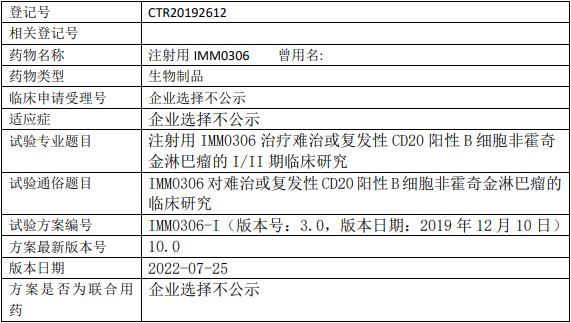
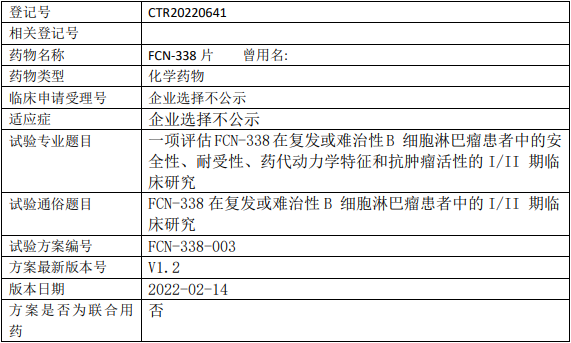
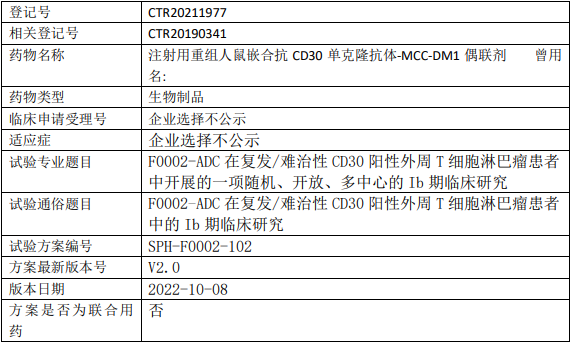
百济神州BGB-11417临床试验,评估Bcl-2抑制剂BGB-11417治疗复发或难治性套细胞淋巴瘤有效性、安全性和药代动力学的II期临床试验
百济神州BGB-11417临床试验,评估Bcl-2抑制剂BGB-11417治疗复发或难治性套细胞淋巴瘤有效性、安全性和药代动力学的II期临床试验
试验目的
本研究由两部分组成
第一部分确定了BGB-11417单药治疗复发或难治性套细胞淋巴瘤(MCL)的安全性和耐受性、最大耐受剂量以及BGB-11417单药治疗复发或难治性套细胞淋巴瘤的2期推荐剂量。
第二部分评估了BGB-11417单药在推荐的2期剂量下治疗复发或难治性套细胞淋巴瘤(MCL)的疗效,推荐的递增方案来自第一部分。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、组织学确诊为MCL
2、既往的MCL全身治疗(至少一种抗cd20免疫或化学免疫治疗,以及至少一种BTKi单药或联合治疗)
3、在最后一线治疗期间或之后未能达到PR 或更佳缓解或出现疾病进展
4、存在可测量的病灶
5、有存档案组织证实MCL的诊断,或愿意接受新鲜的肿瘤活检
6、东部肿瘤合作组(ECOG)体能状态评分为0~2
7、器官功能良好
排除标准
1、已知淋巴瘤累及中枢神经系统累及
2、在过去3年内,除MCL以外的其他恶性肿瘤,除了已治愈的基底或鳞状细胞皮肤癌、浅表性膀胱癌、宫颈癌或乳腺癌原位癌,或Gleason 评分6的前列腺癌
3、之前接触过Bcl-2抑制剂(如维奈克拉/ABT-199)
4、过去3个月内进行过自体干细胞移植;或在最近3个月内接受过嵌合细胞治疗;或在最近6个月内进行过异基因干细胞移植,或目前有需要使用免疫抑制剂的移植物抗宿主病
5、存在有临床意义的心血管疾病
6、在研究药物首次给药前4 周内接受过大型手术
7、需要全身治疗的活性真菌、细菌或病毒感染