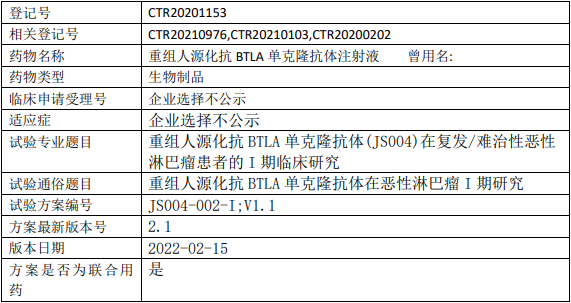
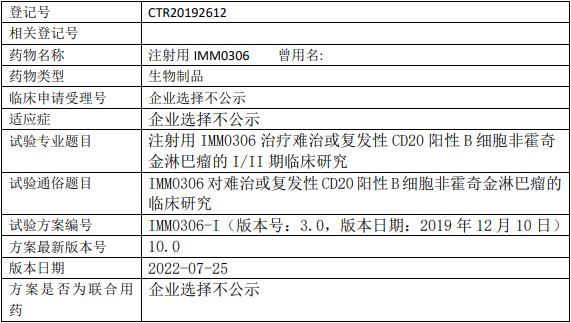
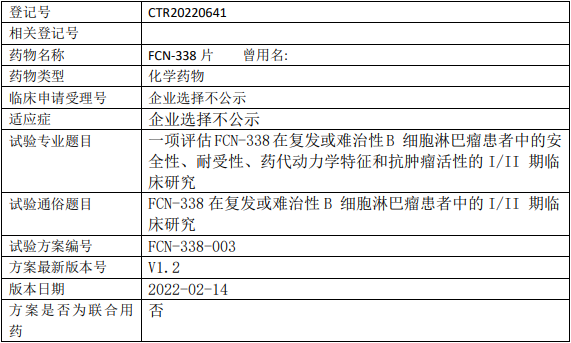
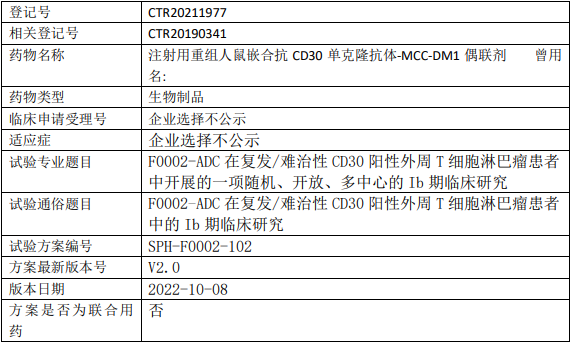
和记黄埔HMPL-689临床试验,评价HMPL-689胶囊治疗复发/难治边缘区淋巴瘤和滤泡性淋巴瘤患者的疗效和安全性的多中心、单臂、开放性的II期临床试验
和记黄埔HMPL-689临床试验,评价HMPL-689胶囊治疗复发/难治边缘区淋巴瘤和滤泡性淋巴瘤患者的疗效和安全性的多中心、单臂、开放性的II期临床试验
试验目的
评价HMPL-689治疗复发/难治边缘区淋巴瘤或滤泡性淋巴瘤患者的疗效、安全性、耐受性及药代动力学。
试验设计
试验分类:其他 其他说明:疗效、安全性、耐受性、药代动力学
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄≥ 18周岁
2、复发/难治的边缘区淋巴瘤或滤泡性淋巴瘤患者
3、ECOG体能状态评分为0-2
4、患者至少有一个可测量的病灶
5、预期存活期超过12周
排除标准
1、有中枢神经系统(CNS)或软脑膜侵犯的淋巴瘤患者
2、已知发生侵袭性淋巴瘤的组织学转化
3、既往曾使用过任何磷脂酰肌醇3-激酶(PI3K)抑制剂
4、肝肾等器官功能不足
5、目前已知的人免疫缺陷病毒,乙型肝炎病毒、丙型肝炎病毒或巨细胞病毒的活动性感染
6、首次研究药物给药前4周内接受过系统性抗肿瘤治疗或放疗
7、首次研究药物给药前,既往抗肿瘤治疗的毒性反应尚未恢复到≤1级水平(脱发除外);
8、合并尚未控制的需要静脉抗生素治疗的系统性感染
9、妊娠期(血清妊娠检查结果呈阳性)或哺乳期女性
10、任何其它疾病,代谢异常,体格检查异常或有显著临床意义的实验室检查异常,根据研究者判断,有理由怀疑患者具有不适合使用HMPL-689的某种疾病或状态,或者将会影响研究结果的解读,或者使患者处于高风险的情况