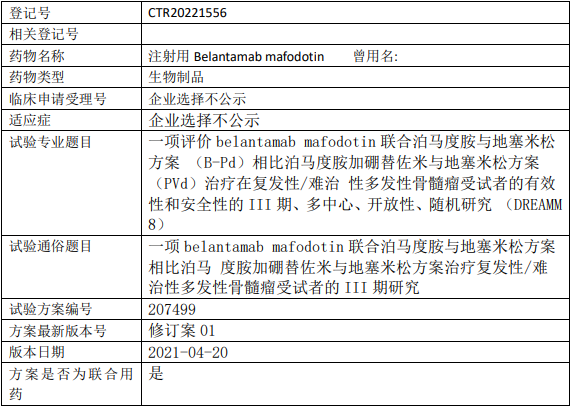
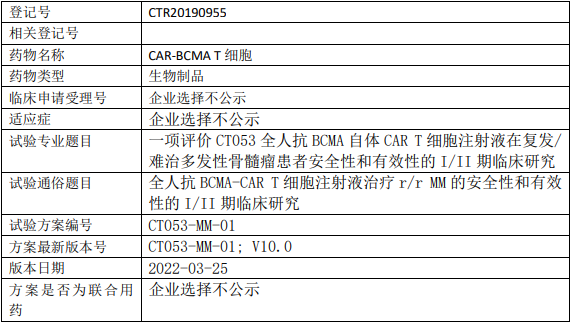
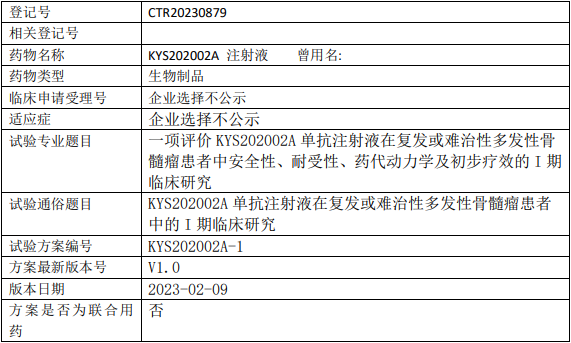
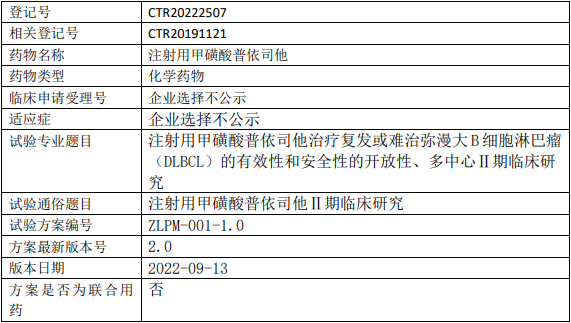
智翔金泰/智翔医药GR1803临床试验,GR1803注射液治疗复发/难治的多发性骨髓瘤安全性、药代动力学、免疫原性和初步疗效的I期临床试验
智翔金泰/智翔医药GR1803临床试验,GR1803注射液治疗复发/难治的多发性骨髓瘤安全性、药代动力学、免疫原性和初步疗效的I期临床试验

试验目的
1、评价GR1803注射液在多发性骨髓瘤患者中安全性、耐受性、最大耐受剂量(MTD)和2期推荐剂量(RP2D);
2、评价GR1803注射液在多发性骨髓瘤患者中的药代动力学特征、免疫原性及初步疗效。
试验设计
试验分类:安全性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、签署知情同意书时年龄18-75周岁,男女均可;
2、ECOG评分0-1分;
3、组织和/或细胞学证实的多发性骨髓瘤患者;
4、筛选时存在可测量病灶;
5、具有充分的器官和骨髓功能;
6、能够理解并遵守临床试验方案要求,资源参加临床试验,并签署知情同意书。
排除标准
1、首次给药前4周内接受其他抗肿瘤治疗;
2、首次给药前4周内参加过其他临床试验;
3、患有其他恶性肿瘤史者;
4、存在心血管疾病风险者;
5、筛选时乙肝表面抗原阳性、乙肝核心抗体阳性、丙型肝炎病毒抗体阳性、艾滋病病毒抗体初筛阳性、抗梅毒螺旋体抗体阳性者;
6、妊娠、哺乳期女性,或筛选期血妊娠检测阳性者;
7、自筛选期至给药结束后6个月内有生育计划、捐献卵子(女性受试者)或捐献精子(男性受试者)计划,且不愿采取有效物理避孕措施;
8、存在严重的心理或精神异常,影响受试者参加本研究的依从性;
9、研究者认为不合适参加本研究的其他原因。