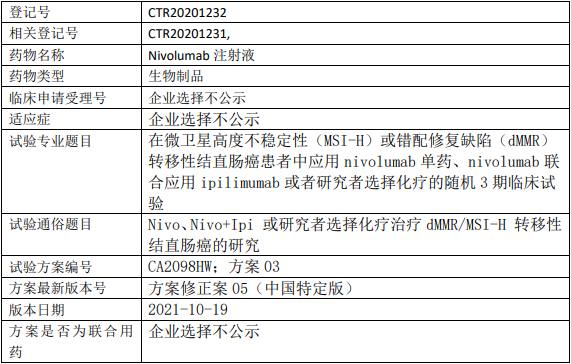
加科思JAB-21822临床试验,评价JAB-21822片联合西妥昔单抗用于KRAS p.G12C突变的晚期结直肠癌、晚期小肠癌、晚期阑尾癌安全性、耐受性、药代动力学和抗肿瘤活性的Ib/II期临床试验
加科思JAB-21822临床试验,评价JAB-21822片联合西妥昔单抗用于KRAS p.G12C突变的晚期结直肠癌、晚期小肠癌、晚期阑尾癌安全性、耐受性、药代动力学和抗肿瘤活性的Ib/II期临床试验
试验目的
在KRAS p.G12C突变的晚期结直肠癌、晚期小肠癌、晚期阑尾癌受试者中评估JAB-21822联合西妥昔单抗的抗肿瘤活性以及安全性、耐受性;评估JAB-21822的药代动力学特征。
试验设计
试验分类:安全性和有效性
试验分期:其它 其他说明:Ib/II
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、在进行任何研究相关的操作之前需获得受试者或其法定代理人签署的书面知情同意书;
2、年龄≥18岁;
3、组织学或细胞学确诊为局部晚期或转移的、不能行根治性治疗的、经标准治疗失败的KRAS p.G12C突变的晚期CRC、晚期小肠癌、晚期阑尾癌受试者:
4、预期生存期≥3个月;
5、良好的器官功能;
6、受试者必须具有至少一个符合RECIST v1.1定义的可测量病灶。
排除标准
1、既往(≤2年)或目前患有其他病理类型的实体肿瘤或血液肿瘤;
2、对试验用药物或赋形剂等成分过敏;
3、乙型肝炎、丙型肝炎或人免疫缺陷病毒(HIV抗体阳性);
4、患有活动性感染或开始首次用药前14天内患有活动性感染;
5、既往(首次用药前≤6个月)或现有证据表明有下列疾病:急性心肌梗死、不稳定心绞痛、脑血管意外;
6、既往(首次用药前≤6个月)患有任何严重的和/或不可控制的疾病或经研究者和申办方判定可能影响受试者参加本研究的其他疾病;
7、既往(首次用药前≤6个月)或现有证据表明有下列疾病:急性心肌梗死、不稳定心绞痛、脑血管意外;
8、既往使用过 KRAS p.G12C 抑制剂或使用过EGFR抑制剂治疗的;
9、在首次给药前28天内进行过大手术、受到过严重创伤,或在治疗期间计划进行大手术的受试者(将由研究者与医学监查员协商后决定);
10、既往诊断角膜炎、溃疡性角膜炎和严重干眼病史的患者;
11、在首次给药前21天内接受过放射性治疗,除外首次给药14天仅限于非靶病灶的姑息性放射治疗;
12、妊娠或哺乳期妇女;
13、存在酗酒、滥用药物或精神性疾病可能影响研究依从性或研究结果评估的受试者。