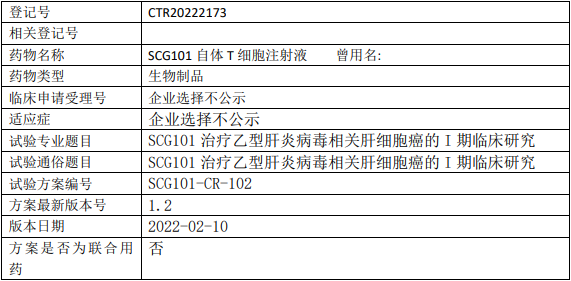
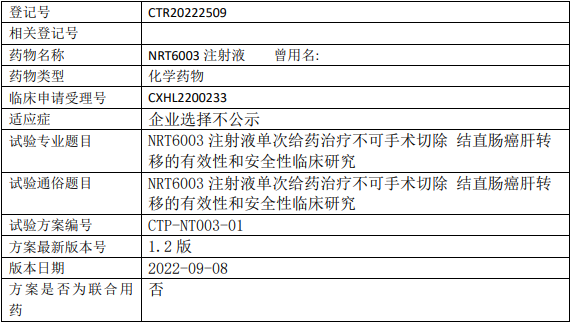
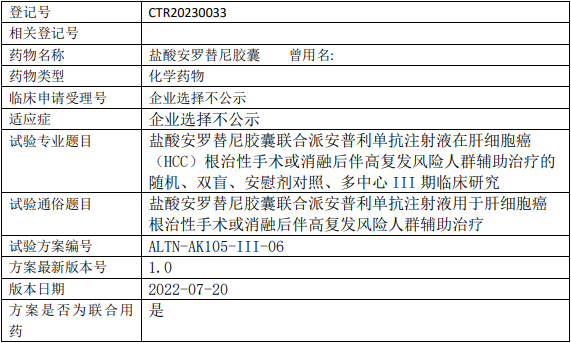
正大天晴安罗替尼临床试验,盐酸安罗替尼胶囊联合派安普利单抗注射液治疗肝细胞癌(HCC)根治性手术或消融后伴高复发风险人群辅助治疗随机、双盲、安慰剂对照、多中心的III期临床试验
正大天晴安罗替尼临床试验,盐酸安罗替尼胶囊联合派安普利单抗注射液治疗肝细胞癌(HCC)根治性手术或消融后伴高复发风险人群辅助治疗随机、双盲、安慰剂对照、多中心的III期临床试验
试验目的
1、通过评估无复发生存期(RFS)来评价盐酸安罗替尼胶囊联合派安普利单抗注射液(试验组)对比安慰剂(对照组)用于HCC根治性手术或消融后伴高复发风险人群辅助治疗的有效性、安全性与耐受性;
2、评价派安普利单抗注射液的免疫原性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者自愿加入本研究,签署知情同意书,依从性好。
2、年龄:18-75周岁(签署知情同意书时);ECOG PS评分:≤1分;预计生存期≥12周。
3、经病理组织学或细胞学检查确诊的HCC或符合《原发性肝癌诊疗规范2022》或美国肝病研究学会(AASLD)肝细胞癌的临床诊断标准的受试者。
4、在随机化前4至12周内接受根治性切除或消融(仅RFA或MWA)的受试者。
5、门静脉无重大大血管侵犯(Vp3或Vp4)或肝静脉或下腔静脉无任何级别的大血管侵犯。
6、无肝外转移。
7、存在高复发风险因素。
8、主要器官功能良好。
9、育龄女性受试者及男性受试者应同意在研究期间和研究结束后6个月内采用避孕措施。
排除标准
1、已知有纤维板层HCC、肉瘤样HCC或混合型HCC(含胆管细胞癌成分)以及其他非肝细胞癌类型的肿瘤。
2、随机化时存在肿瘤残留、复发或转移性疾病的证据。
3、既往接受过任意类型的细胞治疗。
4、4周内参加过其他临床试验。
5、需使用免疫抑制剂或激素治疗以达到免疫抑制目的,并首次给药2周内仍在继续使用的。
6、已知对本研究的研究药物(安罗替尼、派安普利单抗)所含的活性成分、辅料有超敏反应,或曾对任何其他单克隆抗体、抗血管生成靶向药物有严重过敏史。
7、存在任何重度和/或未能控制的疾病的受试者。
8、研究者判定的受试者不适宜参加本研究的其它因素。