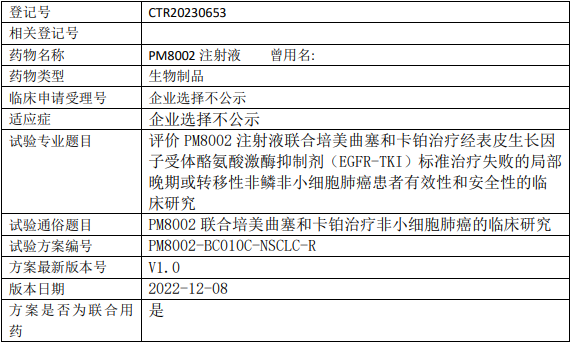
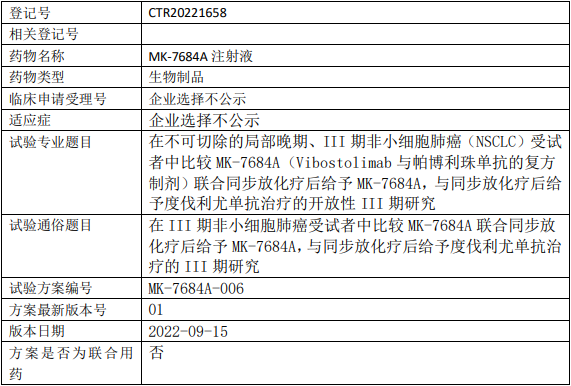
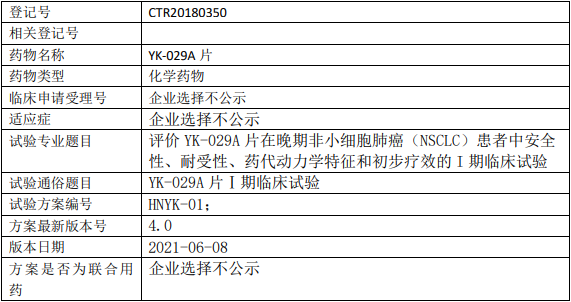
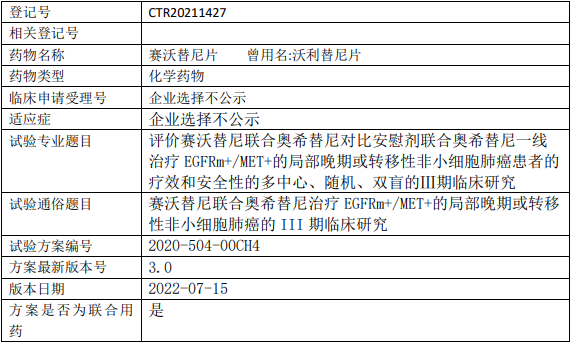
百济神州Tarlatamab临床试验,Tarlatamab(塔拉妥单抗、AMG757)与标准疗法比较治疗接受含铂一线化疗后的复发性小细胞肺癌的III期临床试验
百济神州Tarlatamab临床试验,Tarlatamab(塔拉妥单抗、AMG757)与标准疗法比较治疗接受含铂一线化疗后的复发性小细胞肺癌的III期临床试验

试验目的
比较Tarlatamab与标准疗法(SOC)延长总生存期(OS)的有效性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者在开始任何研究特定活动/操作之前已提供知情同意书。
2、签署知情同意书时年龄≥18岁(或国家的法定成年年龄,以较大者为准)。
3、组织学或细胞学证实的复发/难治性SCLC。
4、受试者在接受1种含铂方案后进展或复发。
5、为中心检测提供可评价的肿瘤样本。
6、在21天筛选期间根据RECIST 1.1定义的可测量病灶。
7、美国东部肿瘤协作组(ECOG)PS评分为0或1。
8、预期寿命≥12周。
9、充足的器官功能。
排除标准
1、未经治疗或有症状的中枢神经系统(CNS)转移。
2、免疫检查点抑制剂的既往用药史。
3、受试者在研究治疗首次给药前7天内出现提示急性和/或不受控活动性全身感染的症状和/或临床体征和/或影像学体征。
4、间质性肺疾病或活动性非感染性肺炎的证据。
5、既往接受过Tarlatamab或作为本试验的一部分纳入的任何SOC化疗治疗。
6、既往接受过任何DLL3通路选择性抑制剂治疗。
7、受试者接受过SCLC的多种既往全身治疗方案。
8、既往诊断为任何转化非小细胞肺癌(NSCLC)、转化为SCLC的表皮生长因子受体(EGFR)激活突变阳性NSCLC或混合SCLCNSCLC组织学。