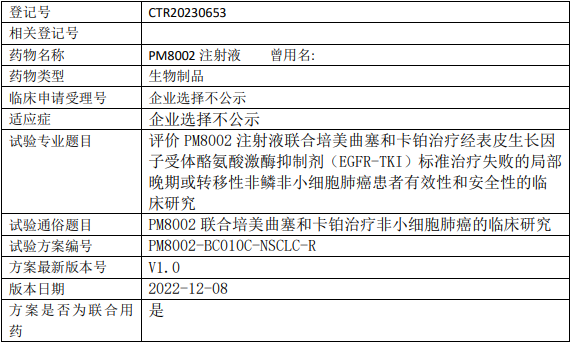
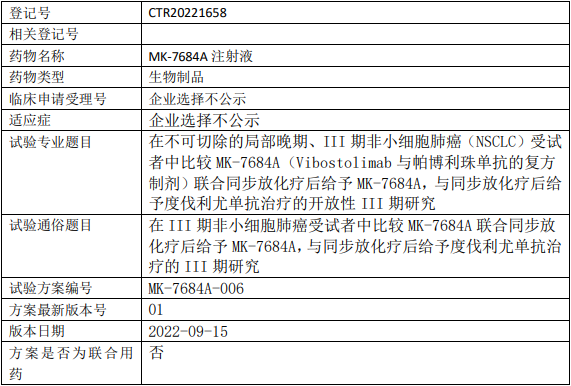
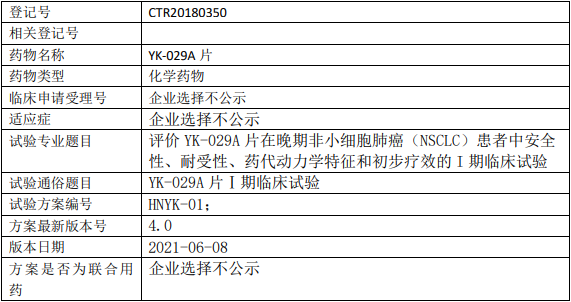
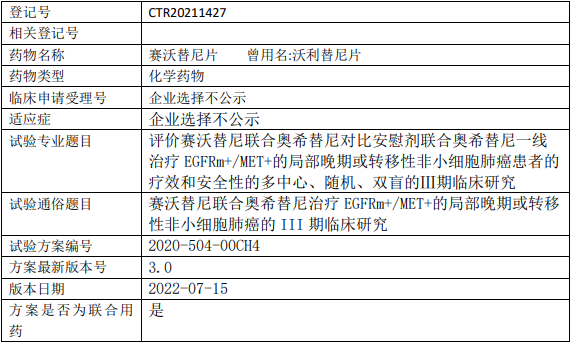
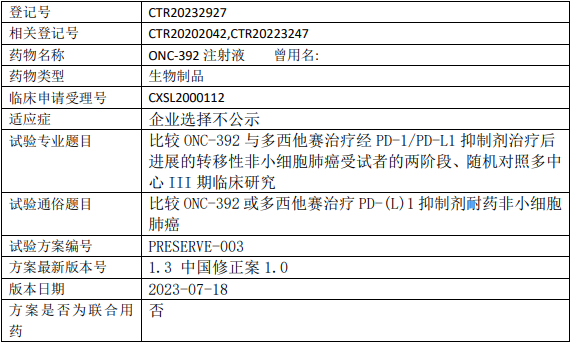
昂科免疫ONC392临床试验,比较ONC-392注射液与多西他赛治疗经PD-1/PD-L1抑制剂治疗后进展的转移性非小细胞肺癌两阶段、随机对照多中心的III期临床试验
昂科免疫ONC392临床试验,比较ONC-392注射液与多西他赛治疗经PD-1/PD-L1抑制剂治疗后进展的转移性非小细胞肺癌两阶段、随机对照多中心的III期临床试验
试验目的
比较ONC-392与多西他赛治疗PD-(L)1抑制剂耐药非小细胞肺癌的有效性和安全性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、成人,性别不限,签署知情同意书当天年龄≥18岁,通过签署书面知情同意书自愿同意参加研究。
2、经组织学或细胞学确诊的转移性非小细胞肺癌,转移包括局部淋巴结或远处器官。
3、末次治疗为PD-1/PD-L1抑制剂联合含铂双药化疗且影像学进展。
4、根据RECIST 1.1,有可测量的疾病病灶。
5、ECOG评分为0或1。
6、必须具有充分的器官功能。
7、预期存活时间必须≥3个月。
8、在筛选访视前至末次用药后90天内避孕。
排除标准
1、既往抗肿瘤治疗引起的AE未恢复到NCI CTCAE v5.0定义的≤1级。
2、首次研究药物用药前28天内参研试验用药物或试验用器械的任何其他临床试验,或同时接 受其他获批的全身性抗肿瘤治疗。
3、正在接受慢性系统性全身性皮质类固醇治疗。
4、存在以下基因的靶向突变或基因组改变的受试者:EGFR、ROS1、MET、BRAF、RET、NTRK、ALK或HER2。
5、用药前4周内有活动性或症状性脑转移或进展证据。
6、有活动性胃肠疾病。
7、有活动性间质性肺疾病或肺炎。
8、在首次研究药物用药前14天内有全身静脉抗菌药物治疗的活动性感染,或在7天内需要口服抗菌药物治疗的活动性感染。
9、在开始研究治疗前6个月内有心血管病史。
10、对多西他赛或聚山梨酯80制剂有重度超敏反应病史。
11、有需要免疫抑制剂治疗的自身免疫性疾病。
12、在开始研究治疗前4周内接受过大手术或预期在研究期间接受大手术。
13、研究者认为受试者不适合参加临床试验。
14、处于妊娠期或哺乳期。