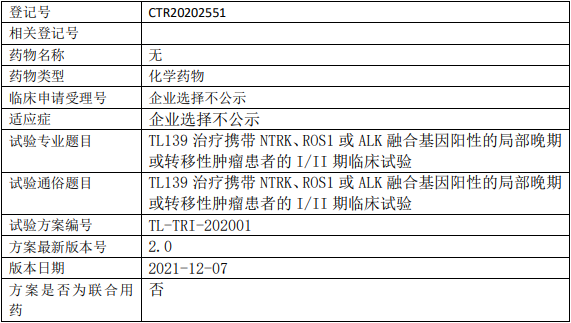
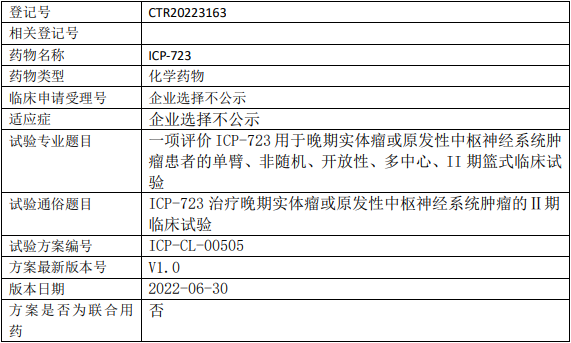
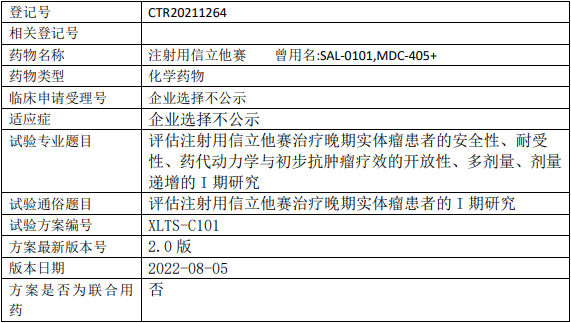
辉瑞Ponsegromab临床试验,评估Ponsegromab注射液治疗癌症恶液质且GDF-15浓度升高的II期临床试验
辉瑞Ponsegromab临床试验,评估Ponsegromab注射液治疗癌症恶液质且GDF-15浓度升高的II期临床试验

试验目的
本研究的目的是在患有癌症、恶液质且GDF-15浓度升高的患者中评估Ponsegromab与安慰剂相比的疗效、安全性和耐受性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:平行分组
随机化:随机化
盲法:双盲
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、筛选时年龄≥18 岁(如果当地法规要求>18 岁,则为最低知情同意年龄)且已签署知情同意书的受试者。na. 如果女性受试者未处于妊娠期或哺乳期,则可参与研究。
2、有NSCLC、PANC 或CRC 的组织学或细胞学诊断记录且接受标准治疗(可以包括系统性治疗)。
3、根据Fearon标准中体重减轻定义的恶液质n1)筛选前6个月内BMI 2%;n或n2)筛选前6个月内无意识体重减轻> 5%(不考虑BMI)。
4、筛选时血清GDF-15 浓度≥1.5ng/mL。
5、研究者评估认为能够参加A部分且ECOG PS评分≤3的受试者。
6、愿意并且能够遵从预定的所有访视、治疗计划、实验室检查、生活方式注意事项和其他研究程序的受试者。
排除标准
1、当前存在进食量减少的可逆原因,由研究者确定。
这些原因可能包括但不限于:
●NCI CTCAE 3级或4级口腔粘膜炎;
●NCI CTCAE 3级或4级胃肠道(GI)疾病(恶心、呕吐、腹泻和便秘);
●导致患者无法进食的机械性梗阻。
2、筛选或随机化时接受胃管喂食或肠外营养(全部或部分)。
3、研究者确定的其他原因导致的恶液质,包括但不限于:
●需要接受家庭氧疗的重度COPD;
●NYHA III-IV 级心力衰竭;
●AIDS。
4、随机化前4 周内接受大手术(中心静脉通路置入和肿瘤活检不视为大手术)。在筛选前,患者必须已从手术的急性影响中恢复良好。患者不应计划在研究期间接受大手术。
5、其他可能增加研究参与的风险或(根据研究者判断)或可能使受试者不适合参加研究的医学或精神状况,包括近期(过去一年内)或目前存在自杀意念/行为或实验室检查异常。
6、对任何治疗性或诊断性单克隆抗体(IgG 蛋白)或由单克隆抗体组分制成的分子有过敏或速发过敏反应史。
7、在研究干预首次给药前4 周内直至研究第16 周开始全身性糖皮质激素的新治疗;允许将稳定(即在前4 周内未显著改变剂量或给药频率)的类固醇治疗(例如地塞米松作为预先用药的一部分或每日口服泼尼松)。
8、与盐酸阿拉莫林同时给药(例如,研究干预首次给药前30 天内至研究第16周)。
9、在研究干预首次给药前30天(或根据当地要求确定)或5 个半衰期(以较长者为准)内至整个研究期间(包括A 部分和B 部分)不允许伴随使用研究用药品(包括药物、生物制剂或疫苗)。
10、入组既往Ponsegromab研究。
11、与转移癌无关的重度肝病或肝硬化病史。还将排除存在以下肝功能检查异常的潜在研究受试者:
●总胆红素≥1.5×ULN(Gilbert综合征除外)nAST>3×ULN(如果肿瘤累及肝脏,则AST> 5×ULN)nALT>3×ULN(如果肿瘤累及肝脏,则ALT>5×ULN)n碱性磷酸酶>3×ULN(如果发生骨转移,则碱性磷酸酶>5×ULN)。
12、需要透析的肾病或2021 CKD-EPI 方程计算出eGFR
13、直接参与研究执行的研究中心工作人员及其家人、以其他方式受研究者监管的研究中心工作人员,以及直接参与本研究执行的申办方和申办方代表员工及其家人。