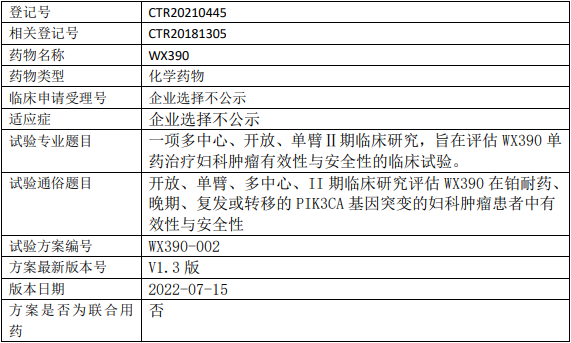
辰欣药业WX390临床试验,评估WX390单药治疗铂耐药、晚期、复发或转移的PIK3CA基因突变的妇科肿瘤有效性与安全性的II期临床试验
辰欣药业WX390临床试验,评估WX390单药治疗铂耐药、晚期、复发或转移的PIK3CA基因突变的妇科肿瘤有效性与安全性的II期临床试验
试验目的
本研究旨在探索WX390治疗妇科肿瘤患者的疗效和安全性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:女
健康受试者:无
出入排标准
入选标准
1、研究者与受试者充分沟通后自愿签署知情同意书。
2、年龄≥18岁的女性。
3、病理组织学和/或细胞学确认的卵巢癌、或子宫内膜癌、或宫颈鳞癌。
4、东部肿瘤协作组(ECOG)体力状态评分为0或1。
5、预计生存时间至少3个月以上。
6、根据RECIST1.1(实体瘤)标准,至少有一个可评估的肿瘤病灶。
7、血常规:中性粒细胞绝对计数(ANC)≥2.0×109/L,血小板计数(PLT)≥100×109/L,血红蛋白(Hb)≥9g/dL。
8、肝功能:总胆红素(TBIL)≤1.5×正常值范围上限(ULN)(确诊的Gilbert综合征患者TBIL≤3×ULN可纳入本研究)。
9、肾功能:肌酐(Cr)≤1.5×ULN,且肌酐清除率>50ml/min(根据Cockcroft-Gault公式计算)。
10、凝血功能:活化部分凝血活酶时间(APTT)≤1.5×ULN,凝血酶原时间(PT)≤1.5×ULN,国际标准化比值(INR)≤1.5×ULN(如果患者正在使用稳定剂量的抗凝或抗血小板聚集的治疗,INR≤2-3×ULN)。
排除标准
1、既往曾接受过某些抑制剂治疗。
2、首次试验药物给药前3年内患有除卵巢癌、宫颈癌、子宫内膜癌以外的其他恶性肿瘤(经适当治疗的非黑色素瘤皮肤癌可以入组)。
3、既往抗肿瘤治疗的不良反应尚未恢复到美国国家癌症研究所不良事件通用术语标准第5.0版(NCICTCAEv5)等级评价≤1级(脱发除外)。
4、明确诊断有脑转移性肿瘤或原发性中枢神经系统肿瘤的受试者、或具有脑转移肿瘤的症状和体征,且尚未被影像学评估的受试者。
5、筛选时患者具有下列不可控制的心脏疾病和/或近期内发生下列心血管事件:
1.开始药物治疗前6个月内发生过心绞痛、冠状动脉旁路搭桥术、心包炎或心肌梗死‘
2.根据纽约心脏病学会分级标准,心衰III-IV级或研究者怀疑受试者心衰并经超声心动图检查左心室射血分数<50%;
3.心动过缓(心率<50次/分)。
6、经合适的药物治疗后,未充分控制的高血压(定义为收缩压>160mmHg和/或舒张压>100mmHg)。
7、首次试验药物给药前30天内接受过主要脏器外科手术或预期在研究过程中需要接受大手术(不包括穿刺活检或中心静脉导管置入术),或出现过显著外伤。
8、在首次试验药物给药前2周内需要抗生素治疗的严重感染,包括但不限于需要住院的感染或需要静脉使用抗生素,例如菌血症或重度肺炎。
9、在首次试验药物给药前30天内,接受其他临床研究中任何试验药物。
10、既往有需要类固醇治疗的间质性肺疾病、药物诱导的间质性肺疾病、放射性肺炎病史或任何临床活动性间质性肺疾病证据。
11、慢性乙型肝炎活动期(HBsAg阳性且HBVDNA≥1000cps/ml或200IU/ml)或活动性丙型肝炎者(抗-HCV抗体且HCVRNA阳性)。
12、对试验药物或试验药物任何成分有严重过敏、过敏或其他超敏反应史。
13、已知有酒精或药物依赖。
14、妊娠与哺乳期女性。
15、患有活动性、或曾患过且有复发可能的自身免疫性疾病的患者、抑郁症或情感障碍、或有自杀倾向者、影响方案依从性或使患者产生治疗并发症高风险或妨碍患者获得知情同意书等,而不适合参加本临床研究。