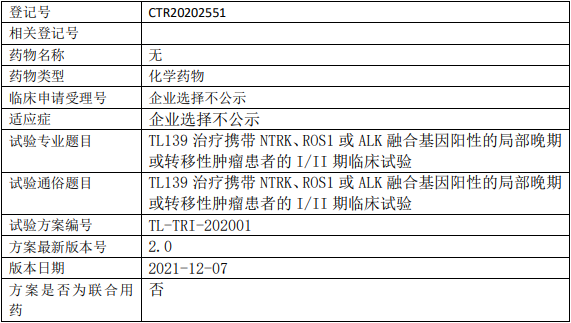
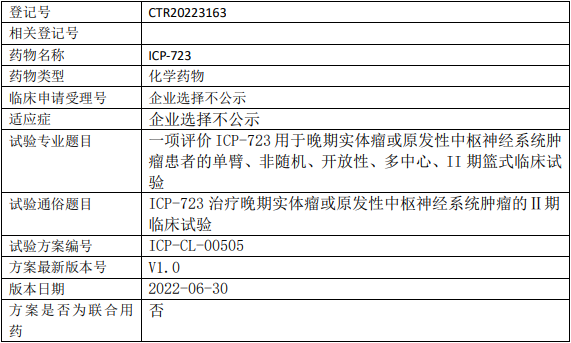
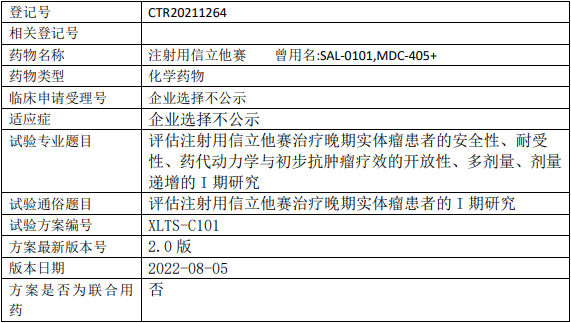
菲鹏生物UCART19临床试验,通用型靶向CD19嵌合抗原受体T细胞(UCART-19细胞)治疗CD19+的复发难治性B细胞急性白血病和侵袭性淋巴瘤的II期临床试验
菲鹏生物UCART19临床试验,通用型靶向CD19嵌合抗原受体T细胞(UCART-19细胞)治疗CD19+的复发难治性B细胞急性白血病和侵袭性淋巴瘤的II期临床试验

研究目的
验证靶向CD19的通用型嵌合抗原受体T细胞(UCART-19)治疗难治/复发急性淋巴细胞白血病和侵袭性淋巴瘤的安全性和有效性。
出入排标准
纳入标准
1、确诊为CD19阳性的复发难治性B细胞急性白血病或侵袭性淋巴瘤患者;
2、年龄18-70岁,男性或女性患者。
3、无明确的中枢神经系统累及的证据;
4、筛选时最小残留病灶(MRD)负荷≥1x10^-3;
5、满足下列任何一条的复发或难治病例:
①初诊急性白血病患者,经两个疗程标准治疗未达缓解者;
②急性白血病复发患者经一个疗程标准化疗未达缓解者;
③急性白血病经两个疗程仍未达MRD阴性者;
④二次或多次复发患者;
⑤异基因造血干细胞移植后(SCT)的任何复发至预计UCAR-T治疗间隔>3个月;
⑥淋巴瘤患者经两个以上含有美罗华方案的标准疗程治疗,肿瘤体积缩小<50%,或化疗期间肿瘤持续增大,或经4个疗程标准治疗(含有美罗华方案),仍有肿瘤存在,或肿瘤缩小/消失后再出现,或出现新发病灶。
6、成人ECOG体力状态分级≤2级;
7、患者有自知能力,或患者签署委托书授权委托者签署知情同意书后加入本研究。
排除标准
1、既往或目前伴有其他恶性肿瘤;
2、使用过抗CD19疗法的任何治疗;
3、2-4级未控制的急性或广泛的慢性移植物抗宿主病;
4、症状性心衰或严重心律失常;超声心动图或MUGA在筛查7天内证实为左心室射血分数(LVEF)<45%;
5、具有严重合并症需用药治疗的患者:
●需要血液透析治疗的严重肾脏疾病;
●严重肺部疾病,吸氧治疗下经皮血氧饱和度仍<90%;
●严重的充血性心力衰竭或射血分数<35%;
6、活动性乙型肝炎病毒(HBV-DNA)或丙型肝炎病毒(HCV)感染(血清 HBV-DNA > 2000IU/mL 或HCV-RNA > 25IU/mL);
7.、血清总胆红素 > 34umol/L(或2.0 mg/dL)或血清门冬氨酸氨基转移酶/丙氨酸氨基转移酶>正常上限的3倍
8、难以控制的严重感染患者;
9、人类免疫缺陷病毒(HIV)抗体阳性患者;
10、妊娠及哺乳期妇女;
11、研究者认为可能增加受试者危险性或干扰试验结果的任何情况。