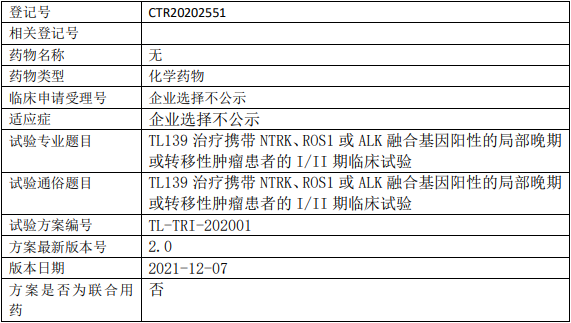
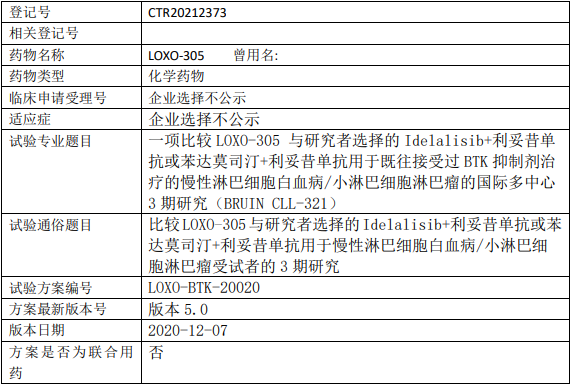
礼来苏州Pirtobrutinib临床试验,比较Pirtobrutinib(LOXO-305、吡妥布替尼)与研究者选择的Idelalisib+利妥昔单抗或苯达莫司汀+利妥昔单抗治疗既往接受过BTK抑制剂治疗的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的III期临床试验
礼来苏州Pirtobrutinib临床试验,比较Pirtobrutinib(LOXO-305、吡妥布替尼)与研究者选择的Idelalisib+利妥昔单抗或苯达莫司汀+利妥昔单抗治疗既往接受过BTK抑制剂治疗的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的III期临床试验
试验目的
评估LOXO-305单药治疗(A组)对比苯达莫司汀+利妥昔单抗(BR)(B组)的无进展生存期(PFS)。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、根据iwCLL2018标准明确诊断为CLL/SLL
2、既往接受过试验用共价BTK抑制剂或已批准上市的共价BTK抑制剂治疗
3、东部肿瘤协作组(ECOG)体能状态评分为0-2分
4、中性粒细胞绝对计数(ANC):没有粒细胞集落刺激因子(G-CSF)支持的情况下≥0.75×109/L
5、血红蛋白在C1D1前14天内不给予输血支持或生长因子治疗的情况下≥8g/dL
6、血小板在C1D1前14天内不给予输血支持或生长因子治疗的情况下≥50×109/L。如果研究者选择苯达莫司汀/利妥昔单抗作为B组治疗药物,则血小板必须≥75×109/L
7、丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)≤3.0×正常上限(ULN)
8、总胆红素≤1.5×正常上限(ULN)
9、肌酐清除率≥30mL/分钟
排除标准
1、入组研究之前任何时间已知或怀疑出现Richter转化
2、已知或怀疑患者有CLL/SLL的中枢神经系统(CNS)累及病史
3、活动性药物诱导的肝损伤
4、活动性不能控制的自身免疫性血细胞减少症
5、重大心血管疾病
6、异体或自体干细胞移植(SCT)术治疗史或60天内接受过嵌合抗原受体T细胞(CAR-T)治疗。
7、活动性乙型肝炎或丙型肝炎
8、已知的活动性巨细胞病毒(CMV)感染。
9、不能控制的活动性全身性感染(细菌性、病毒性真菌或寄生虫感染)
10、已知的人类免疫缺陷病毒(HIV)感染,无论CD4阳性的细胞计数如何。
11、具有临床意义的活动性吸收不良综合征或炎症性肠病
12、既往接受过非共价(可逆性)BT需要使用华法林或另一种维生素K拮抗剂进行抗凝治疗的患者。K抑制剂治疗。
13、需要使用华法林或另一种维生素K拮抗剂进行抗凝治疗的患者。
14、正在接受强效细胞色素P450(CYP)3A4(CYP3A4)抑制剂或诱导剂和/或强效P-糖蛋白(P-gp)抑制剂治疗。
15、在随机分组之前28天内接种活疫苗。
16、存在以下超敏反应的患者:
1)已知对LOXO-305、Idelalisib、苯达莫司汀的任何成分或辅料存在超敏反应;
2)既往存在利妥昔单抗诱导的显著超敏反应。