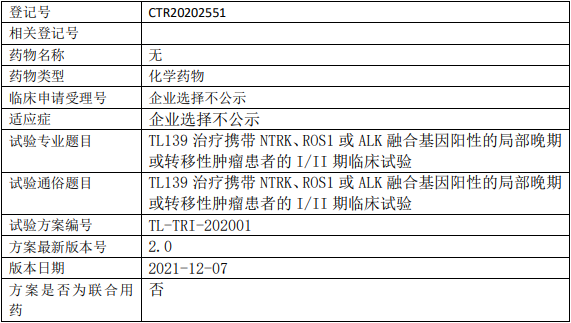
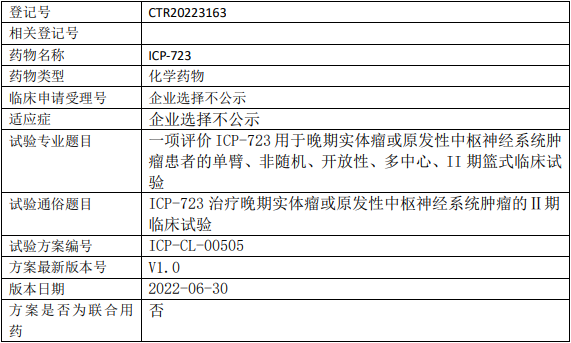
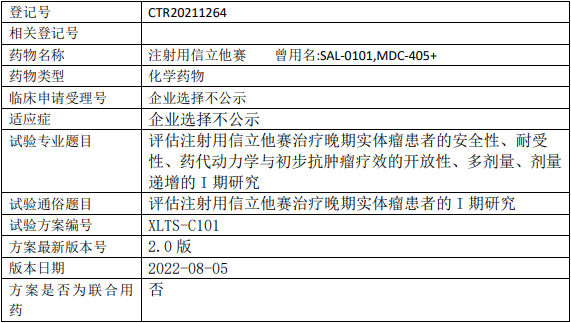
科伦博泰SKB264临床试验,评价SKB264注射液与帕博利珠单抗联合用药在选定实体瘤受试者中的有效性和安全性的II期临床试验
科伦博泰SKB264临床试验,评价SKB264注射液与帕博利珠单抗联合用药在选定实体瘤受试者中的有效性和安全性的II期临床试验
试验目的
主要目的
安全性:评价SKB264与帕博利珠单抗联合用药在选定实体瘤受试者中的安全性
有效性:评价SKB264与帕博利珠单抗联合用药在选定实体瘤受试者中的客观缓解率(ORR)
次要目的
安全性:评价SKB264与帕博利珠单抗联合用药在选定实体瘤受试者中的其他安全性特征
有效性:评价选定实体瘤受试者接受SKB264与帕博利珠单抗联合用药的疾病控制率(DCR)、缓解持续时间(DOR)无进展生存期(PFS)、总生存期(OS)
药代动力学(PK):评价SKB264与帕博利珠单抗联合用药的PK特征
免疫原性:确定SKB264与帕博利珠单抗联合用药的潜在免疫原性
试验设计
试验分类:其他 其他说明:安全性和有效性,包含药代动力学研究
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、签署知情同意书时年龄≥ 18岁的受试者。
2、美国东部肿瘤协作组(ECOG)体能状态评分为0或1的受试者,对于不能耐受含顺铂化疗的尿路上皮癌受试者,允许ECOG体能状态评分为2。
3、预期生存期≥ 3个月的受试者
4、队列A:复发或转移性宫颈癌受试者
5、队列B:局部晚期或转移性尿路上皮癌受试者
6、队列C:铂敏感复发性卵巢癌受试者
7、队列D:转移去势抵抗性前列腺癌受试者
8、根据实体瘤疗效评价标准(RECIST)1.1,至少有一个可测量病灶的受试者
9、能够在首次给药前提供肿瘤组织块或切片(对于存档肿瘤组织:福尔马林固定石蜡包埋的组织块或切片用于生物标志物检测
10、具有充分的器官功能和骨髓功能
11、受试者必须从既往治疗导致的所有毒性中恢复(即改善至0级或1级,或达到入选资格标准中规定的水平)
12、男性和女性受试者使用的避孕措施必须符合当地法规对于临床研究受试者的避孕方法要求
13、受试者能够签署知情同意书,其中包括ICF和本方案中列出的要求和限制
排除标准
1、已知患有活动性或未经治疗的中枢神经系统(CNS)转移和/或癌性脑膜炎的受试者
2、在过去5年内患有已知的正在进展或需要积极治疗的其他恶性肿瘤的受试者。
3、患有具有临床意义的心血管疾病的受试者。
4、患有严重和/或未经控制的伴随疾病的受试者。
5、诊断为活动性乙型肝炎或丙型肝炎的受试者。
6、已知有人类免疫缺陷病毒(HIV)检查阳性病史或已知有获得性免疫缺陷综合征(艾滋病)的受试者。
7、已知有活动性肺结核的受试者。
8、在研究治疗首次给药前30天内接受过重大手术(由研究者定义)或仍在前期手术的恢复期的受试者。
9、已知对帕博利珠单抗/SKB264或帕博利珠单抗/SKB264的辅料有过敏或超敏反应的受试者。
10、有异体组织/实体器官移植史的受试者。
11、既往接受过TROP2靶向药物治疗的受试者。
12、既往任何时候使用含有拓扑异构酶I的抗体药物偶联物治疗早期或转移性疾病的受试者。
13、既往使用过任何试验性抗肿瘤疫苗,或任何靶向T细胞共刺激或免疫检查点通路的药物的受试者,PD-1/PD-L1抑制剂除外。
14、首次研究治疗给药前30天内接种了活疫苗,或计划在研究期间接种活疫苗的受试者。
15、正在参与另一项临床研究的受试者,除非是观察性(非干预性)临床研究或干预性研究的随访期。
16、研究者认为存在会干扰研究治疗评估或受试者安全或研究结果解释的任何情况。